Participar
As pessoas com doença, em particular as entidades que os representam, dado o conhecimento e perspetivas únicas da sua convivência com a doença, podem contribuir para acrescentar valor ao processo de tomada de decisão através da sua participação e envolvimento em diferentes processos do Infarmed.
Ainda em desenvolvimento em outras áreas, atualmente o Infarmed conta com esse envolvimento nos seguintes processos:
As novas tecnologias de saúde são submetidas a uma avaliação técnica, terapêutica e económica (Avaliação de Tecnologias de Saúde), com posterior decisão sobre o financiamento e utilização no Serviço Nacional de Saúde (SNS). Esta avaliação é realizada pelo Infarmed, através da Direção de Avaliação de Tecnologias de Saúde (DATS) e da Comissão de Avaliação de Tecnologias de Saúde (CATS).
Ao participarem na avaliação de tecnologias de saúde, os doentes têm a oportunidade de identificar as suas prioridades e preferências. As informações recolhidas poderão ajudar os profissionais da DATS e da CATS a entenderem o impacto real que um novo medicamento ou tecnologia pode ter na qualidade de vida dos doentes e seus cuidadores.
PICO
No âmbito do processo de avaliação de um novo medicamento, é necessário identificar a população e o(s) medicamento(s) comparador(es), bem como as medidas de avaliação de benefício (eficácia) e dano (segurança).
É nesta fase do processo, designada de PICO, que o Infarmed envolve mais diretamente as pessoas com doença, em particular as entidades que os representam, no âmbito do Incluir.
O envolvimento das pessoas com doença, em particular as entidades que os representam, nos processos de avaliação de tecnologias de saúde concretiza-se através da submissão formal de contributos.
As entidades capacitadas serão convidadas a participar com a submissão de contributos sempre que existir em avaliação um novo medicamento que corresponda à sua área terapêutica de intervenção.
Para esse efeito o Infarmed disponibiliza um questionário, que inclui um guião para o seu correto preenchimento, sendo solicitado um prazo de resposta de aproximadamente três semanas, para que os seus contributos possam ser integrados e enquadrados no prazo limitado de avaliação dos peritos.
Concluído o processo de Avaliação de Tecnologias de Saúde as entidades participantes são informadas sobre o seu resultado.
A Farmacovigilância visa melhorar a segurança dos medicamentos, em defesa do utente e da Saúde Pública, através da deteção, avaliação e prevenção de reações adversas, ou seja, uma resposta nociva e não intencional a um ou mais medicamentos. A informação que é recolhida através da notificação de reações adversas é vital para garantir a monitorização contínua da segurança dos medicamentos existentes no mercado, permitindo identificar potenciais reações adversas desconhecidas, quantificar e/ou melhor caracterizar reações adversas previamente identificadas e implementar medidas que permitam minimizar o risco da sua ocorrência.
A Direção de Gestão do Risco de Medicamentos assegura a coordenação e funcionamento do Sistema Nacional de Farmacovigilância de Medicamentos de Uso Humano, designadamente no que respeita à recolha, avaliação e divulgação da informação sobre as suspeitas de reações adversas dos medicamentos, à análise de relações de causalidade entre medicamentos e reações adversas e à identificação precoce de problemas de segurança com a utilização de medicamentos.
O conhecimento, as perspetivas e experiências únicas das pessoas que convivem com doença, nomeadamente as entidades que os representam (as Associações de Pessoas com Doença) podem ser um contributo valioso para o processo de Farmacovigilância, por meio de ajuda aos seus associados no processo de notificação de reações adversas ou na partilha e avaliação da informação relacionada com os materiais educacionais dirigidos aos doentes e/ou seus cuidadores relativos a determinados medicamentos.
Apoio à notificação de reações adversas
Sem necessidade de registo no Incluir ou de frequência de ações de capacitação, as Associações de Pessoas com Doença podem ter um papel relevante na capacitação e informação dos seus associados relativamente à notificação (dado que qualquer profissional de saúde e cidadão - doente que sofreu a reação ou o seu familiar/cuidador - podem notificar suspeitas de reações adversas).
Para notificar de forma fácil, acessível e rápida, sem intermediação de terceiros, basta aceder ao Portal RAM e preencher os campos com toda a informação possível.
Avaliação de materiais educacionais
Os materiais educacionais surgem da necessidade de alertar e informar os profissionais de saúde envolvidos na prescrição, dispensa ou administração do medicamento, e também os doentes e/ou cuidadores, sobre os riscos importantes (identificados ou potenciais) de um determinado medicamento, eventualmente, quando não é ainda conhecida determinada informação de segurança ou quando se pretende recordar ou reforçar determinada informação sobre o risco.
Os materiais educacionais, a maioria disponíveis na ficha do medicamento na Infomed, complementam a informação do Resumo das Características do Medicamento (RCM) e/ou do Folheto Informativo (FI) e têm como objetivos:
No âmbito do Incluir, as entidades capacitadas serão convidadas a participar no procedimento de avaliação de materiais educacionais, bem como na medição da sua efetividade.
Para esse efeito foi instituído um processo de consulta às Associações de Pessoas com Doença assente nos seguintes passos:
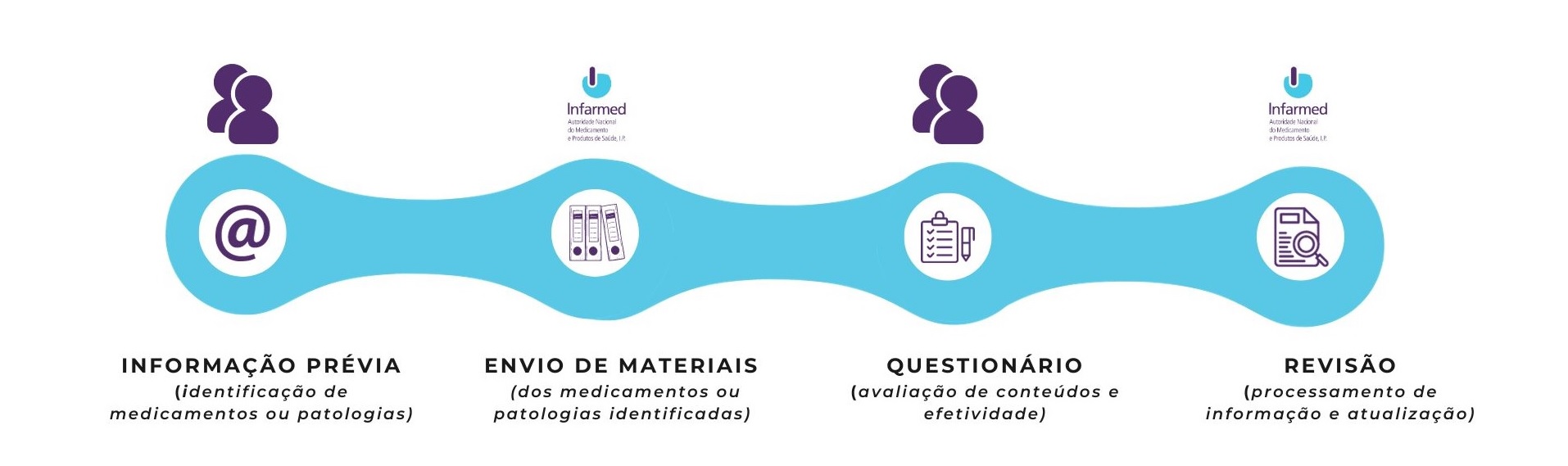
1. Informação prévia
Como primeiro passo, as Associações de Pessoas com Doença sinalizam ao INFARMED, I.P., via email (info.seguranca@infarmed.pt), quais os medicamentos ou patologias relacionadas com os seus associados. Sempre que pretenderem, estas entidades podem atualizar a informação anteriormente remetida.
2. Envio de materiais educacionais
Neste segundo passo, cabe ao Infarmed remeter às Associações de Pessoas com Doença, via email, todos os materiais educacionais dos medicamentos que estas identificaram ou dos medicamentos com indicação nas patologias que identificaram. Os materiais educacionais a remeter reportam aos acordados com os titulares de Autorização de Introdução no Mercado (primeiras versões e versões subsequentes) e dirigidos aos doentes e/ou seus cuidadores.
3. Preenchimento de questionário
Juntamente com o passo anterior, o Infarmed remete também um questionário para recolha de comentários, com o objetivo de:
- obter a perceção geral sobre os materiais educacionais que são dirigidos aos doentes e/ou cuidadores
- recolher opinião sobre o que mudariam nesta forma e formato de comunicar os riscos
- obter opinião sobre os textos utilizados na transmissão do risco
4. Revisão
Neste último passo, o Infarmed processa a informação recolhida a qual será utilizada no procedimento de avaliação de materiais educacionais dirigidos aos doentes e/ou cuidadores, bem como na medição da sua efetividade.
A garantia do acesso dos cidadãos aos medicamentos de que necessitam assume-se como uma das mais relevantes vertentes do direito fundamental à proteção da saúde.
A Unidade de Projetos Interinstitucionais e para o Sistema de Saúde (USS) é uma unidade orgânica diretamente dependente do Conselho Diretivo do Infarmed à qual compete a integrada gestão da disponibilidade do medicamento.
O conhecimento, perspetivas e experiências únicas das pessoas portadoras de doença podem ser um contributo valioso para o processo de gestão de disponibilidade de medicamentos, tanto na fase de notificação, como na fase de avaliação de impacto de indisponibilidade de medicamentos.
Notificação
A notificação de faltas é um elemento muito importante para a profícua atuação do Infarmed junto do circuito de distribuição e das empresas titulares, tendo em vista a resolução dos problemas que estão na origem do eventual desabastecimento.
Com vista à facilitação e sistematização do processo de notificação de faltas o Infarmed disponibiliza um formulário de reporte de faltas de medicamentos. As pessoas portadoras de doença, ou as entidades que os representam, podem usar este formulário, na qualidade de “Cidadão”, sem necessidade de registo no Incluir ou de frequência de ações de capacitação.
Avaliação de impacto
O Infarmed procede à análise individualizada de todas as notificações de ruturas do fornecimento do abastecimento de medicamentos, bem como das cessações de comercialização.
A avaliação de impacto considera os seguintes critérios: existência de medicamentos similares, existência de outros medicamentos autorizados com a mesma substância ativa, dosagem, forma farmacêutica ou via de administração, existência de outros medicamentos autorizados em outros grupos fármaco-terapêuticos e com as mesmas indicações, análise da quota de mercado, stocks existentes e impacto para o cidadão.
O impacto divide-se em três níveis:
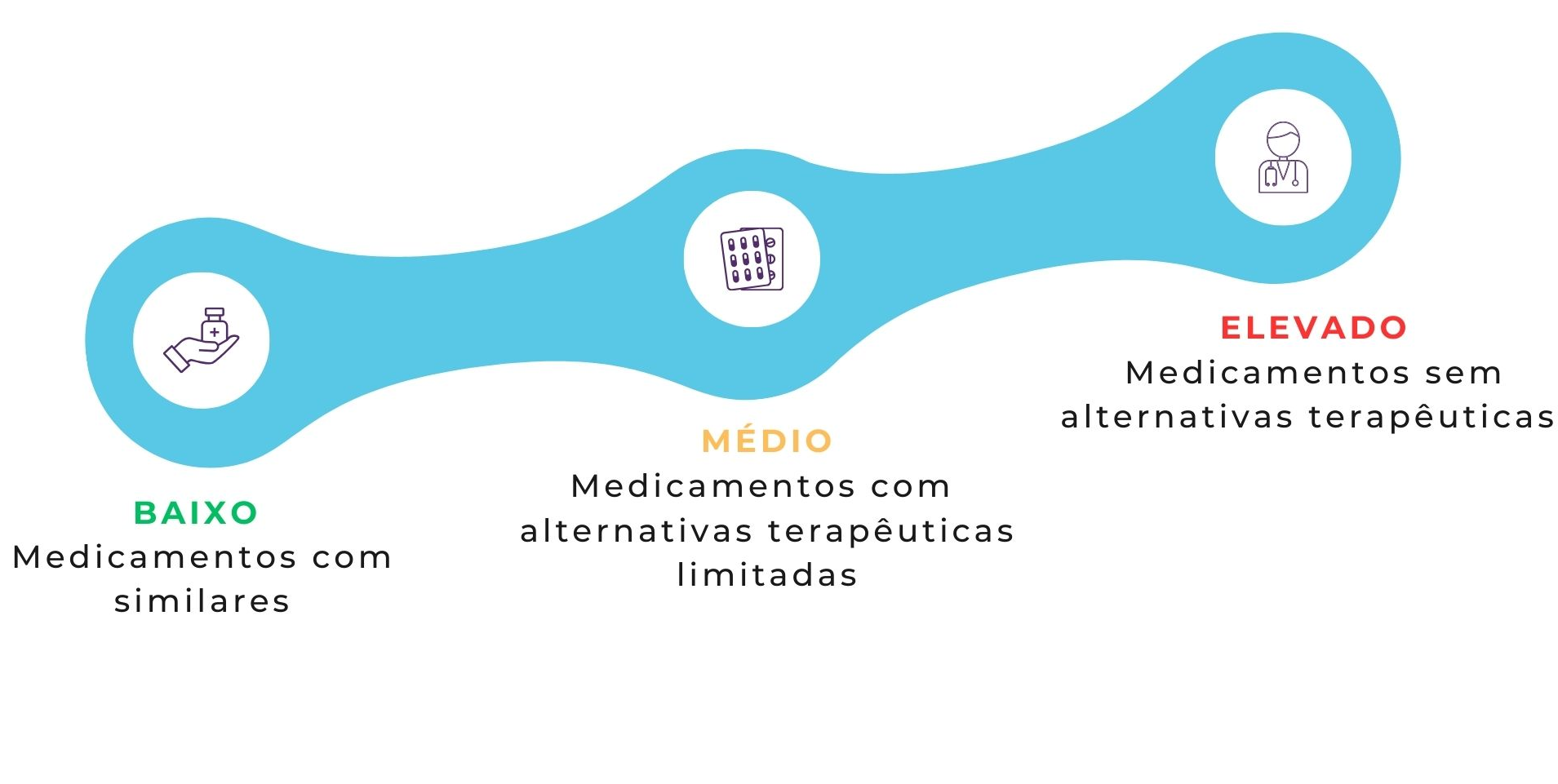
No âmbito do Incluir, as entidades capacitadas serão convidadas a participar na avaliação de impacto, com a submissão de contributos, nos casos de indisponibilidade de medicamentos correspondentes à sua área de intervenção. Estes contributos serão recolhidos nos casos considerados de impacto elevado e, pontualmente e sempre que se considere relevante, também em casos específicos de impacto médio.
Para esse efeito o Infarmed disponibilizará um questionário para recolha de informação e auscultação das associações de pessoas com doença relativa ao impacto e dificuldades sentidas em resultado da temporária indisponibilidade de determinados medicamentos. Esta auscultação é reservada a associações registadas no Incluir com frequência de ação de capacitação sobre este tema.


